
 | |
|
Главная » Публицистика 0 ... 109 110 111 112 113 114 115 ... 159 Хлорное железо FeCls применяют в качестве коагулянта реже из-за трудностей обращения с ним. Сернокислый алюминий при известковании воды с большим значением рН образует хорошо растворимые в воде соединения - алюминаты. Расход извести для проведения процесса декарбонизации воды определяется приведенными выше уравнениями; кроме того, необходим дополнительный расход извести на реакцию с коагулянтом и некоторый ее избыток (0,5 мг-экв/л) для ускорения процесса декарбонизации. Из способов реагентного умягчения воды наибольшее распространение получил известково-содовый благодаря более широким границам его применимости. Дозирование в воду извести вызывает осаждение магния в виде Mg-(OH)2, но жесткость воды при этом не уменьшается, так как происходит лишь замена магниевой жесткости кальциевой в соответствии с реакциями: MgS04 4- Са(0Н)2 = Mg(0 H)2 -Ь CaS04; MgCl2 4- Са(0Н)2 =-М£(0Н)2 + СаСЬ. Жесткость некарбонатная, обусловленная в основном наличием соединений кальция, устраняется реагентом, содержащим анионы COs~ , обычно кальцинированной содой ЫагСОз: CaS04 4- NasCOa = СаСОз 4" N32804; СаСЬ 4- NaaCOs = СаСОз 4- 2NaCl. Доза извести (в пересчете на СаО) при известково-содовом способе умягчения воды может быть определена по формуле (в мг/л) Ди = 28 \+Ж + Ж + Дк + ИУ где 28 - эквивалентная масса СаО; COg- содержание в воде свободной углекислоты в мг/л; Жк - жесткость карбонатная в мг-экв/л; Жм- жесткость магниевая в мг-экв/л; Дк-доза коагулянта в мг-экв/л; Яи- избыток извести, принимаемый равным 0,5 мг-экв/л. Доза соды (в пересчете на 100% НагСОз) составляет (в мг/л) = 53(Жнк4-Дк4-Яс), где 53 -эквивалентная масса соды; Жн.к-жесткость некарбонатная в мг-экв/л; Ис-избыток соды против теоретического количества, принимаемый равным 1 мг-экв/л. В результате обработки воды известью или известью с содой происходит некоторое снижение солесодержания исходной воды. Фосфатирование обычно применяется с целью более глубокого умягчения воды (до 0,04-0,05мг-экв/л), предварительно обработанной другими способами, при температуре воды выше 100° С. При введении в обрабатываемую воду тринатрийфосфата или дина-трийфосфата протекают реакции образования труднорастворимых фосфорнокислых солей кальция Саз(Р04)2 и магния М§з(Р04)2- § 123. УСТАНОВКИ ДЛЯ РЕАГЕНТНОГО УМЯГЧЕНИЯ ВОДЫ Реагентные водоумягчительные установки обычно состоят из следующих основных элементов: 1) устройств для приготовлення растворов, водораспределителей, дозаторов, реагентов; 2) смесителей; 3) камер 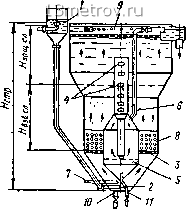 хлопьеобразования; 4) аппаратов, в которых завершается умягчение воды и происходит частичное ее осветление (вихревые реакторы, термо-умягчители, напорные и безнапорные осветлители); 5) осветлительных фильтров. Точное дозирование реагентов при обработке воды с целью ее умягчения имеет важное значение для успешного осуществления технологического процесса. Обычно критерием правильности подбора доз реагентов и завершения процесса умягчения служит показатель стабильности воды. Известь обычно дозируют в виде известкового раствора или молока. Для приготовления осветленного насыщенного раствора извести на установках малой производительности (до 100 м/ч) применяют сатураторы. Сатуратор - это непрерывно действующий аппарат (до перезарядки, которая производится обычно раз в сутки), выполняющий также роль дозатора известкового раствора. Применение осветленного насыщенного раствора извести позволяет осуществлять простую и точную его дозировку. Однако на крупных установках по экономическим соображениям от применения сатураторов отказываются и приготовляют не насыщенный раствор извести, а известковое молоко с концентрацией 5%. Для приготовления молока используют баки со специальными устройствами, предотвращающими расслоение известковой взвеси и раствора. Такими устройствами являются лопастные или гидравлические мешалки и система дырчатых труб для подачи сжатого воздуха. Для подачи известкового молока к смесителям необходимо выбирать кратчайшее расстояние. Важным элементом дозировочных устройств на водоумягчительных установках является водораспределитель, на котором обрабатываемая вода делится водосливами с постоянной или регулируемой шириной порога на несколько потоков (в подогреватель, в сатуратор, в дозатор). Соотношение между расходами (потоками) сохраняется при изменении величины общего расхода воды. Отделенные таким образом в распределителе потоки используются для автоматического дозирования (управления дозаторами, например сатуратором). Водораспределители выбирают по каталогу водоподготовительного оборудования на заданную пропускную способность. Осветлитель является основным аппаратом водоумягчительной реа-гентной установки. Расчет осветлителя производится так же, как и расчет осветлителя, применяемого для обычного осветления воды. В практике реагентного умягчения воды широкое распространение получили осветлители ЦНИИ МПС, разработанные проф. Е. Ф. Кургаевым. На рис. V.65 показано устройство осветлителя ЦНИИ I-A производительностью 100 мч. Вода в осветлитель вводится через тангенциально расположенное сопло 2, чем обеспечивается вращательное движение ее в нижнем конусе, необходимое для перемешивания реагентов, вводимых по трубе 7. Вращательное движение гасится нижней дренажной решеткой 3 Рис. V.65 / - воздухоотделитель; 2 - ввод воды в осветлитель (тангенциально располо женное сопло); 3 - нижняя распредели тельная решетка; 4 - окна для удале ния избытка шлама; 5-шламоуплот китель; - принудительный отсос. 7 - ввод реагентов, в - стабилизатор взвешенного слоя; 9 - сбросной желоб 10 и 11 - выпуски осадка И вертикальными перегородками, расположенными внизу центральной части осветлителя. Для улучшения гидравлических условий сбора осветленной воды имеется верхняя дренажная решетка. Отбор избытка осадка из взвешенного слоя производится через окна 4, расположенные на вертикальной трубе; подвижные кожухи на окнах позволяют изменять как высоту, так и площадь отбора. На установках большей производительности применяются осветлители ЦНИИ-3 (см. рис. V.28). Взвешенный хлопьевидный осадок в основном состоит из соединений Са и Mg, естественной взвеси и продуктов коагуляции. Осветлители со взвешенным осадком практически могут быть использованы для известкования, а также для известково-содовой обработки воды любого качества. Однако они хорошо работают только при поступлении в них воды с постоянной температурой. Резкое изменение температуры (на 1-2") вызывает появление конвективных токов, взмучивание слоя взвешенного осадка и вынос его из осветлителя на фильтры. Для окончательного осветления умягченной воды применяют обычные скорые фильтры. Расчет и описание конструкций этих фильтров приведены в главе 20. 124. ОСНОВЫ КАТИОНИТНОГО УМЯГЧЕНИЯ ВОДЫ Умягчение воды по методу ионного обмена основано на свойстве ка-тионитов обменивать катионы, которыми предварительно «заряжены» его активные группы, на содержащиеся в умягчаемой воде катионы кальция и магния. В результате реакции катионит отдает в воду взамен поглощенных обменные катионы. В зависимости от того, каким обменным ионом «заряжен» катионит: натрием, водородом или аммонием - различают процессы Na-, Н- и ЫН4-катионирования. Процесс обмена ионов между катионитами и раствором, содержащим соли жесткости, зависит от многих факторов. Главными из них являются свойства катионитов, состав исходной воды и условия происходящего процесса. Все эти факторы тесно связаны между собой и прежде всего определяют скорость прохождения ионообменных реакций. Реакция обмена между катионитом и ионами исходной воды, являющейся раствором солей, обусловливается диффузией ионов из раствора внутрь катионита и из катионита в исходную воду. Процесс управляется законами диффузии и действия масс. При умягчении воды, содержащей ионы кальция и магния, Na-катио-нированием кальций и магний будут диффундировать в катионит; в свою очередь натрий из катионита диффундирует в воду. В результате обменной реакции кальций и магний займут место вытесненного натрия в ка-тионите, а натрий займет место магния и кальция в умягченной воде. Обмен ионов между катионитом и растворами (водой) происходит эквивалентно: из катионита ионы Na+ вытесняются в количестве, эквивалентном количеству ионов Са2+ и Mg2+, поглощаемых из раствора. Обмен ионов является не только эквивалентным, но и обратимым процессом. Обратимость обмена ионов заключается в том, что скорость обмена иона, вытесненного из катионита, и иона, поглощенного из раствора, при условии равновесия практически равна. Эквивалентность и обратимость обмена ионов нарушаются в том случае, если наряду с обменом ионов в воде протекают другие реакции, например окислительно-восстановительные, физическая сорбция молекул и др. При ведении процесса Na-катионирования (как и других процессов) для практических целей главной задачей является максимальное использование ионообменной способности (емкости) катионита, ибо от нее и 0 ... 109 110 111 112 113 114 115 ... 159 |