
 | |
|
Главная » Публицистика 0 ... 22 23 24 25 26 27 28 ... 137 3) твердо-жидкие поглотители - вещества, которые в процессе осущки воздуха и поглощения воды из него переходят из твердого состояния в жидкое (хлористый кальций). 15.8.1. Осушение воздуха жидкими поглотителями (абсорбентами) Абсорбенты поглощают влагу, но могут и отдавать ее в зависимости от разности давления пара в воздухе и над поверхностью раствора. Условия равновесия давления пара зависят от температуры и концентрации раствора. Концентрацию раствора выражают отношением массы растворенного вещества к массе раствора Gg 4- G, %: г-т, (15.91) Gg 4 G где Gg-масса воды. Физические свойства растворов характеризуются фазовой диаграммой (рис. 15.44). Криоскопическая кривая АБВ определяет условия насыщения раствора и делит диаграмму на верхнюю часть, соответствующую жидкой фазе Ж, и нижнюю часть, левая половина которой характеризует условия выпадения льда Л, а правая-условия выпадения кристаллов К из насыщенного раствора. Точка Б, при которой .отсутствует жидкая <ага, таэътва?гтс14 -шч-жгъ-ческой. На фазовую диаграмму наносят также значения аналога относительной влажности воздуха над поверхностью раствора =Рр/Р., (15.92) где упругость водяного пара над поверхностью раствора при заданной его температуре; i-упругость водяното пара над поверхностью воды при той же температуре. При температуре раствора выше температуры, соответствующей криоскопическому состоянию, упругость водяного ггара р и величина ф (при малых концентрациях) являются функцией температуры замерзания раствора. Эти величины практически одинаковы д.,1я раствора различных солей (рис. 15.45). Если на J - с/-диаг рамму нанести кривые насыщения воздуха над растворами солей с температурами замерзания от О до -40С, то, начиная от температуры замерзания, эти кривые отклоняются влево от кривой ф - 100%. °0 1С сз- esi <аг сз*
0 2 4 6 в 10 12 П 16 16 КОНЦЕНТРАЦИЯ, % Рис. 15.44. Фазовая диаграмма для раствора поваренной соли 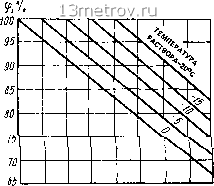 О -10 -20 -30 -40 ТЕМПЕРАТУРА ЗАМЕРЗАНИЯ РАСТВОРА, °С Рис. 15.45. Относительная влажность воздуха ф в пограничном слое над водными растворами солей При температуре воздуха выше О ° кривые могут рассматриваться как кривые относительной влажности. Н.Н.Павлов в 1970 г. на обычную J - с/-диаграмму (рис. 15.46) нанес кривые концентрации водного раствора хлористого лития. Этой совмещенной диаграммой удобно пользоваться при выполнении расчетов процессов осушения влажного воздуха и воздуигной десорбции ослабленного раствора. Диаграмма зависимости парциального давления водяного пара над водным раство- I? Рп,кПа 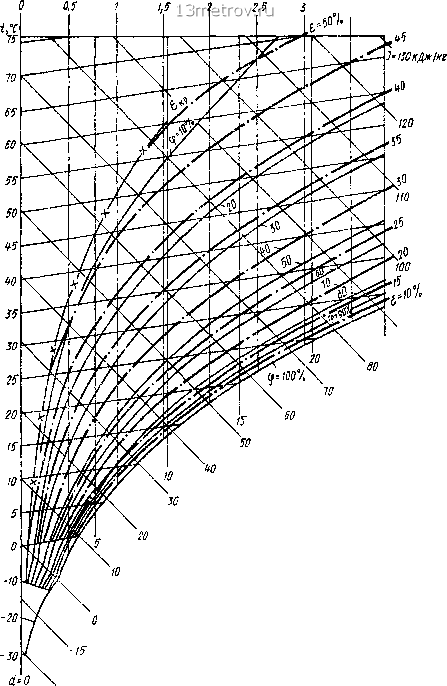 Рис. 15.46. «/-диа1рамма влажного воздуха с кривыми концентрации водного раствора хлористого лития шг то концентрация, моль to tS 2t 68,5 40 26,6 I 2,66 f,55 - 0,8 ~ 0,4 -0,266 - 0,155 1000 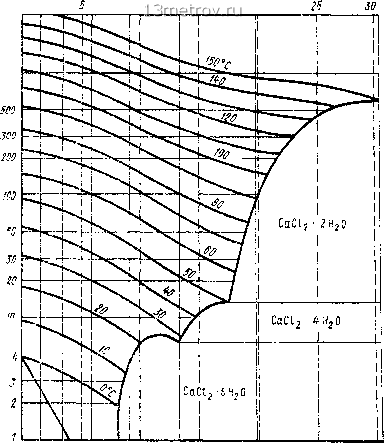 О 10 20 SO 40 50 60 концентрация раст90ра,% Рис. 15.47. Зависимость парциатьяого давления вотяного пара от адниентра!!ги и температуры водною раствора хлористого кальция ром хлористого кальция, котопой можно пользоваться и для растворов доугих солей при мапых концентрациях (ро 20%) и с одинаковой температурой замерзания, приведена на рис. 15.47. Диаграммы для растворов хлористого лития приведены на рис 15.48 -15.49. Поглощение воды из воздуха сопровождается выдетением теплоты гидрат?»пии, растворения, разбавления и конгтенсапии. Эти данные для раствора хлористого кальпик приведены на рис. 15.50. Наиболее широко для осушки воздуха применяются хлористый катьцшт CaClj 6Н2О и хлористый литий LiCl. Свойства их растворов привечены в табл 15.20 и 15.21, на рис. 15.44-15.50. Сема процесса тепло- и влагообмена в мокром воздухоохладителе, который орошается раствором соли данной температуры, построена на J - гУ-диаграмме (рис. 15.51). При одинаковой температуре воздуха, раствора и воды воздух ппсле орошения раствором (прямая 1-2 3) становится суше, чем при орошении водой (прямая / 2-J), так клк rfj <d2-Относительную влажность воздуха можно понизить с помощью раствора ZiCI до 14 -23%, 0 ... 22 23 24 25 26 27 28 ... 137 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||